Len patří mezi nejdéle pěstované kulturní plodiny, spolu s ječmenem a pšenicí byl využíván již 6000 př.n.l.
Podobně jako většina zemědělských plodin, počátky komerčního šlechtění lnu pro zvýšení užitkových vlastností (celkový výnos, obsah oleje, výnos vlákna) pak spadají do devatenáctého století, kdy se jednalo především o cílený výběr jednotlivých rostlin s požadovanými znaky. Len setý (Linum usitatissimum L.) je samosprašná rostlina, jejíž šlechtění může probíhat jak formou klasických šlechtitelských postupů (křížení a výběr), tak pomocí nových technik jako je haploidizace, mutace, tkáňové kultury nebo transformace. V současné době, i když je k dispozici několik šlechtitelských postupů, je nejvyužívanější metodou klasické křížení. Touto cestou (křížení a následná selekce) lze získat odrůdu za cca 15 let, proto se používá řada následných postupů, jak tuto dobu zkrátit. Alternativní metodou ke klasickému postupu – opakovaným selekcím, je odstraňování genetické variability ve šlechtitelském materiálu pomocí prašníkové kultury. V konvenčním procesu šlechtění lnu trvá šest až osm let k získání inbredních linií, které jsou homozygotní. Vznik dihaploidních jedinců však umožňuje produkci zcela homozygotní materiálu za méně než rok a tím urychluje proces šlechtění. Prašníková kultura je v současné době nejúspěšnější způsob získání dihaploidních linií, ovšem celková účinnost regenerace rostlin lnu je velmi nízká. Cílem experimentů bylo zvýšit procento získaných dihaploidních rostlin za pomoci aplikace derivátů cytokininů a tím přispět k rychlejším výsledků šlechtění.
Materiál a metody
Pro experimenty byly použity tři odrůdy lnu – Jitka, Tábor a Venica (získané z kolekce genových zdrojů firmy AGRITEC, výzkum, šlechtění a služby, s.r.o.) a jedno novošlechtění AGT 583/05 (původ novošlechtění - AGRITEC, výzkum, šlechtění a služby, s.r.o.). Pro kulturu mnohonásobných prýtů byly sterilně odebrány segmenty hypokotylů lnu (0,5cm) a týden kultivovány na médiu Li (MS médium, 0.005µM NAA, 1µM BAP). Poté byly přeneseny na médium L (MS médium, 0.005µM NAA, 0,05µM BAP), médium L-I (MS médium, 0.005µM NAA, 0,05µM BAP, 1µM INCYDE), médium L-T (MS médium, 0.005µM NAA, 1µM BAP9THP). Po 8 týdnech byly vyhodnoceny růstové parametry – počet a délka prýtů a počet pupenů. Pro získání prašníků a následně kalusů byl použit postup publikovaný v Metodice prašníkové kultury (Tejklová, 2008). Izolované prašníky byly kultivovány na médiu AC (MS médium, 1µM NAA, 2µM metatopolin) po dobu 8 týdnů. Prašníky, které tvořily kalus, byly pasážovány na médium AB (MS médium, 1µM BAP), AB-I (AB médium, INCYDE) a AB-T (AB médium, 1µM BAP9THP), každé tři týdny přeneseny na čerstvé médium stejného složení. Detekce ploidie byla provedena na průtokovém cytometru Ploidy Analyser PA od firmy Partec Wolf & Danniel s.r.o. Správnost měření byla ověřena pomocí standardu-materiálu se známým počtem chromozómů nebo určenou velikostí genomu.
Výsledky
V první fázi experimentů byla použita kultura mnohonásobných prýtů (multiple shoot-tip culture) regenerovaná ze segmentů hypokotylů klíčních rostlin, která je vhodná pro mapování a srovnání reakce jednotlivých odrůd na přidané látky v in vitro podmínkách. Na kultuře mnohonásobných prýtů byl proveden pokus, ve kterém byly kromě kontrolní šlechtitelské linie AGT583/05 kultivovány také hypokotyly odrůd Jitka, Tábor a Venika. Chování těchto odrůd v in vitro podmínkách je popsáno (Smýkalová a kol., 2010) a bylo tedy možné porovnat získané údaje o růstových parametrech a vyhodnotit tedy i potenciální vliv genotypu. Byl potvrzen vliv genotypu - olejný len AGT583/05 má průkazně vyšší schopnost produkovat prýty a pupeny ve srovnání s přadným typem lnu. Dalším poznatkem z pokusů s kulturou mnohonásobných prýtů je, že i u odrůd citlivých a neregenerujících v in vitro podmínkách (odrůda Venica, Tábor) přídavek dvou výše uvedených derivátů průkazně ovlivnil schopnost regenerace prýtů na explantát (Tab. 1).
Tabulka 1: Srovnání vlivu médií s růstovými regulátory na regeneraci jednotlivých genotypů (hodnoty se vztahují vždy průměrně k jednomu explantátu): P/PO=počet prýtů, P/DÉ=délka prýtů, PU/PO=počet pupenů
|
AGT 583/05 |
Jitka |
Venika |
Tábor |
|||||||||
|
médium |
P/ PO |
P/ DÉ |
PU/ PO |
P/ PO |
P/ DÉ |
PU/ PO |
P/ PO |
P/ DÉ |
PU/ PO |
P/ PO |
P/ DÉ |
PU/ PO |
|
L |
0,8 |
3,875 |
3,3 |
0,7 |
3,571 |
2,2 |
1 |
2,5 |
3,2 |
0,4 |
2,5 |
2,6 |
|
L-I |
3,4 |
3,706 |
10,4 |
3,9 |
3,026 |
4,6 |
2,4 |
2,083 |
5,4 |
1,8 |
2,5 |
6,2 |
|
L-T |
3,3 |
3,818 |
9,5 |
3,7 |
3,622 |
4,9 |
2,5 |
2,4 |
8,8 |
2,8 |
3,28 |
5,4 |
Po ověření vlivu derivátů a genotypů na regenerační schopnosti explantátů na kulturu mnohonásobných prýtů byly v další fázi tyto poznatky aplikovány při práci s prašníkovými kulturami lnu. Izolované prašníky jednotlivých genotypů byly umístěny dle původní metodiky na médium AC, které se osvědčilo z hlediska kalogeneze (Tejklová, 2008). Ze čtyř genotypů nejvíce tvořil kalus genotyp AGT583/05 – u 3,1% prašníků, na rozdíl od odrůd Venica (2,19%), Tábor (1%) a Jitka (0,64%) (Tab. 2).
Tabulka 2: Počty izolovaných prašníků a zregenerovaných kalusů u jednotlivých genotypů
|
genotyp |
vlastnosti |
počet izolovaných prašníků |
počet zregenerovaných kalusů |
počet kalusů / počet izolovaných prašníků (%) |
|
Jitka |
přadný len |
3600 |
23 |
0,64 |
|
Tábor |
přadný len |
3500 |
35 |
1 |
|
Venica |
přadný len |
2550 |
56 |
2,19 |
|
AGT583/05 |
olejný len |
2990 |
95 |
3,1 |
|
Celkem ks |
12640 |
209 |
- |
|
Získané kalusy byly následně pasážovány (po cca 2 měsících na médiu AC) na média AB-I a AB-T. I zde byl potvrzen vliv testovaných derivátů cytokininu na následnou regeneraci prýtů (INCYDE, BAP9THP), přičemž růstový regulátor INCYDE měl na tento parametr statisticky průkazný pozitivní vliv (Tabulka 3). Tím se lišil od BAP9THP, jehož aplikace neindukovala vyšší tvorbu prýtů.
Tabulka 3: Srovnání průměrného počtu prýtů regenerovaných z jednoho kalusu na médiu AB-I a AB-T

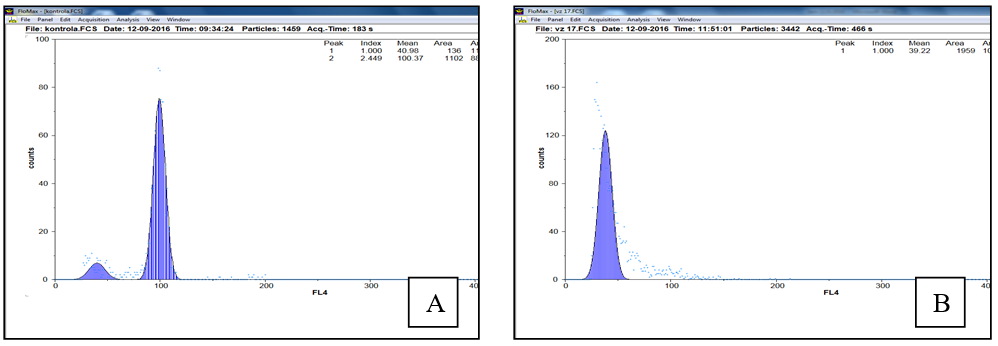
U jednotlivých vybraných prýtů (vždy z jednoho unikátního kalusu) bylo provedeno stanovení počtu chromozomů pomocí flowcytometrie. U několika zregenerovaných prýtů se podařilo identifikovat haploidní sadu chromozomů (Obrázek 1). Z těchto byly následně dopěstovány rostliny a získána semena, použitelná pro další šlechtění.
Obrázek 1 : flowcytometrie – A) kontrola - diploidní rostlina B) haploid
Závěr
Metodika prašníkové kultury u lnu byla vyvíjena na základě řady publikovaných prací (Rutkowska-Krause et al., 2003, Obert et al., 2004) a dlouhé řady vlastních experimentů majících za cíl prostudovat vliv různých faktorů na prašníkovou kulturu a nalézt co nejefektivnější způsob produkce dihaploidních linií lnu aplikovatelný na široký šlechtitelský materiál. Výsledky mnohaleté práce byly použity při vypracování metodiky pro šlechtění lnu (Tejklová, 2008) a následně metodiky prašníkové kultury lnu setého s aplikací nových syntetických derivátů cytokininů (Vrbová, 2017). Těchto metodik lze využít v praktickém šlechtění. Příkladem odrůdy, která byla vyšlechtěna při zařazení prašníkové kultury, je odrůda Raciol. Tato odrůda vznikla křížením mutantní nízkolinolenové linie olejného typu NLN248 (vyvinutá ve firmě Agritec) s australskou odrůdou olejného lnu Areco s klasickou skladbou mastných kyselin v semenném oleji, nositelem vysoké odolnosti ke komplexu houbových chorob. Z rostlin F3 generace byla v roce 2000 založena prašníková kultura. Po několika letech výběru a selekcí byla v letech 2006–2007 byla tato linie pod označením AGT 997/05 testována a v roce 2008 byla přihlášena do registračního řízení, během něhož prokázala vysoký výnos semene a neobvyklou skladbu mastných kyselin. Po 3 letech zkoušení byla na začátku roku 2011 registrována jako odrůda Raciol. Stejný původ z prašníkové kultury má i hnědosemenná odrůda Agram, uznaná v roce 2017. Za posledních 10 let tedy byly uznány 3 české odrůdy olejného lnu, z čehož dvě vznikly právě za přispění zařazení prašníkové kultury do procesu šlechtění. Z výše uvedených výsledků vyplívá, že optimalizace metodiky prašníkové kultury za použití derivátů růstových regulátorů lnu má své opodstatnění.
Literatura
Obert, B., Dedičová, B., Hricová, A., Šamaj, J., Preťová, A. (2004): Flax anther culture: effect of genotype, cold treatment and media. Plant Cell Tiss. Organ Cult. 79: 233–238.
Rutkowska-Krause, I., Mankowska, G., Lukaszewicz, M., and Szopa, J. (2003): Regeneration of flax (Linum usiatissimum L.) plants from anther culture and somatic tissues with increased resistance to Fusarium oxysporum. Plant Cell Reports 22 (2): 110–116.
Smýkalová I., Vrbová M., Tejklová E., Větrovcová M., Griga M. (2010): Large scale screening of heavy metal tolerance in flax/linseed (Linum usitatissimum L.) varieties tested in vitro. Industrial Crops and Products 32: 527-533.
Tejklová, E. (2008): Metodika prašníkové kultury u lnu setého (Linum usitatissimum L). Vydal AGRITEC Plant Research, s.r.o. v Nakladatelství AGRITEC Výzkum, šlechtění a služby s.r.o. Šumperk 2008. ISBN: 978-80-903868-5-3.
Vrbová, M., Smýkalová, I.(2017): Metodika prašníkové kultury lnu setého s aplikací nových syntetických derivátů cytokininů. ISBN:978-80-87360-56-9
Poděkování
Tato práce vznikla za finanční podpory věcné etapy č.B.2.8 řešení úkolu MZe ČR 206553/2011-17253 ”Národní program konzervace a využívání genetických zdrojů rostlin a agrobiodiversity” a RO1018
Autor:
Ing. Miroslava Prokopová, Ph.D.
AGRITEC, výzkum, šlechtění a služby, s.r.o.
Zemědělská 2520/16
Šumperk 787 01
Česká republika
Tato e-mailová adresa je chráněna před spamboty. Pro její zobrazení musíte mít povolen Javascript.
tel: +420 583382125
mobil: +420 725936819
